Przygotowany wykaz stanie się podstawą dalszych prac nad objęciem refundacją technologii lekowych ujętych w wykazie.
Tworzenie wykazu technologii lekowych o wysokim poziomie innowacyjności (TLI) jest rozwiązaniem systemowym, którego celem jest wsparcie działań zmierzających do poprawy zdrowia i jakości życia.
Ocenie zostały poddane leki, dla których decyzja o pozwoleniu na dopuszczenie do obrotu w procedurze centralnej w Unii Europejskiej (UE) została wydana od 1 stycznia 2023 r. do dnia 31 grudnia 2023 r., dla których decyzje o dopuszczeniu do obrotu zostały opublikowane do dnia 31.12.2023 r.). Według zestawienia Europejskiej Agencji Leków (European Medicines Agency, EMA) w ww. okresie dopuszczono do obrotu na terenie UE 60 produktów leczniczych.
Z procesu wykluczono leki, które uzyskały pozwolenie na dopuszczenie do obrotu na podstawie dokumentacji biorównoważności lub biopodobności. Pozostałe 45 technologii lekowych to leki oryginalne.
Spośród 45 leków oryginalnych, które zakwalifikowano do dalszej selekcji, ocenie poddano produkty, dla których decyzja o pozwoleniu na dopuszczenie do obrotu obejmuje zastosowanie w onkologii lub w chorobach rzadkich oraz dla których do dnia opublikowania wykazu TLI nie został złożony wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu.
Łącznie kryteria selekcji do oceny spełniło 23 produkty lecznicze, z czego większość to leki ze wskazaniem w chorobach onkologicznych (ok. 70%). Część leków to produkty zarejestrowane w chorobie onkologicznej z jednoczesnym statusem leku sierocego (ang. orphan) (ok. 38%).
W procesie oceny jeden z leków stracił status leku sierocego, wobec tego został wyłączony z oceny.
Ponadto, zgodnie z informację otrzymaną od MZ (na dzień 29 lutego 2024 r.) dla czterech leków został złożony wniosek o objęcie refundacją, dlatego nie spełniały one kryteriów oceny w ramach TLI.
Spośród produktów spełniających łącznie wszystkie kryteria selekcji (18), dwa leki miały więcej niż jedno wskazanie do oceny i zostały ocenione odrębnie w każdym z zarejestrowanych wskazań. W konsekwencji oceniono 20 technologii lekowych.
Zgodnie z przeprowadzoną analizą, część z ocenianych technologii nie ma finansowanej w ocenianych wskazaniach alternatywnej technologii, co można potraktować jako istnienie niezaspokojonej potrzeby medycznej, choć należy także podkreślić, że sama dostępność technologii w danym wskazaniu nie jest jednoznaczna z zaspokojeniem potrzeb zdrowotnych w danej jednostce chorobowej.
W trakcie oceny zwracano szczególną uwagę na jakość dostępnych dowodów naukowych, która wiąże się z wiarygodnością analizowanych wyników oraz wpływa na (nie)pewność wnioskowania. A także oceniano efekty zdrowotne terapii mając na względzie czy punkty końcowe są pierwszorzędowymi czy zastępczymi punktami końcowymi, a także czy różnica wielkości efektu zdrowotnego między interwencją a komparatorem jest znacząca.
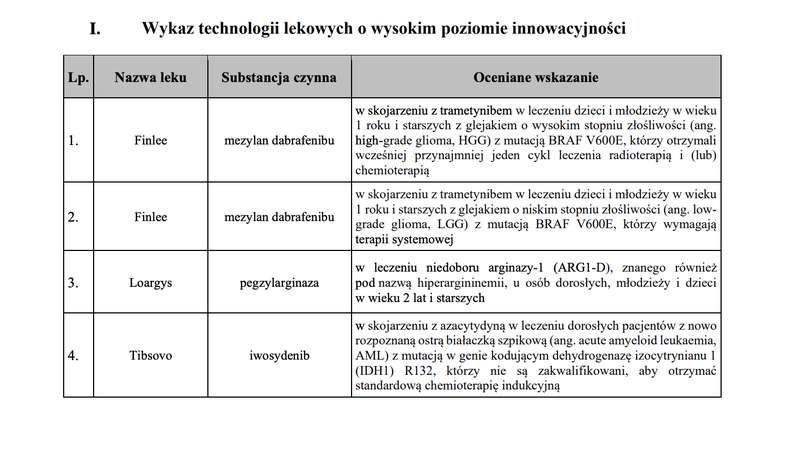
Na podstawie przeprowadzonej oceny technologii lekowych z uwzględnieniem kryteriów ustawowych, utworzono wykaz TLI, który uwzględnia 4 technologie lekowe.
Wykaz jest pierwszym etapem
Utworzenie wykazu TLI to pierwszy etap procesu refundacyjnego dla technologii lekowych o wysokim poziomie innowacyjności. Kolejnym jest utworzenie przez Ministra Zdrowia listy TLI po wcześniejszym zasięgnięciu opinii Rady Przejrzystości, Konsultantów Krajowych oraz Rzecznika Praw Pacjenta. Umieszczenie technologii na liście TLI Ministra Zdrowia umożliwia przejście do następnego etapu, czyli składania zgodnie z art. 24 ust. 1 pkt 1b ustawy o refundacji wniosków o objęcie danej technologii refundacją.
Źródło: AOTMiT: