Z leczenia blinatumomabem będą teraz mogli skorzystać w Europie dorośli pacjenci z ostrą białaczką limfoblastyczną (ALL) z komórek prekursorowych linii B bez chromosomu Philadelphia i z ekspresją antygenu CD19, w pierwszej lub drugiej całkowitej remisji, ze stwierdzoną minimalną chorobą resztkową (ang. minimal residual disease, MRD), większą lub równą 0,1%.
Decyzję o rozszerzeniu wskazań oparto wynikach badania II fazy BLAST, w którym uczestniczyli pacjenci w pierwszej lub kolejnej remisji. Badanie to wykazało, że u 78% pacjentów w czasie jednego cyklu leczenia blinatumomabem uzyskano całkowitą odpowiedź MRD, czyli brak wykrywalnej choroby resztkowej. Wyniki bezpieczeństwa wśród pacjentów z minimalną chorobą resztkową były zgodne ze znanym profilem bezpieczeństwa blinatumomab, stosowanego u pacjentów z nawrotową lub oporną na leczenie białaczką limfoblastyczną z komórek prekursorowych linii B. Badanie BLAST jest największym, jak dotąd, prospektywnym badaniem dotyczącym minimalnej choroby resztkowej w ostrej białaczce limfoblastycznej.
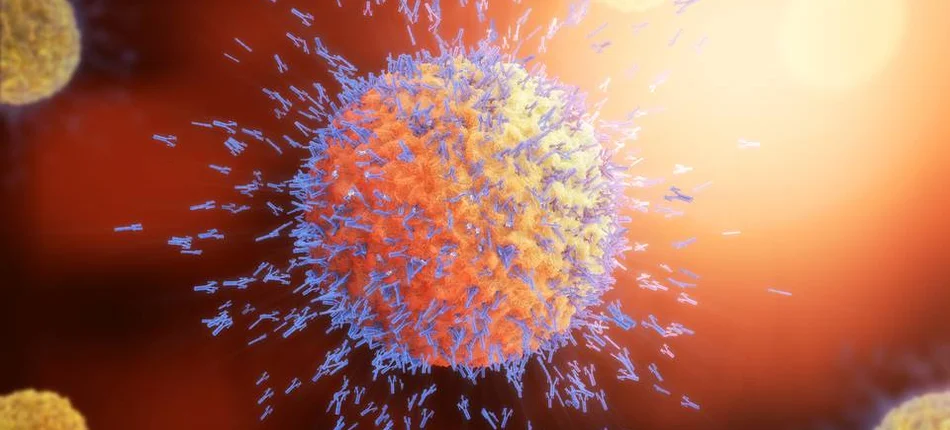
Blinatumomab jest bispecyficznym zmodyfikowanym przeciwciałem angażującym limfocyty T, które wiąże się swoiście z cząsteczką CD19 i z cząsteczką CD3 oraz pierwszą immunoterapią BiTE®, która została zatwierdzona globalnie.
Na czym polega immunoterapia BiTE®?
Bispecyficzne zmodyfikowane przeciwciała angażujące limfocyty T (BiTE®) są nowatorską technologią immunoonkologiczną, która może zostać zaprojektowana jako terapia skierowana w dowolny antygen nowotworowy, pojawiający się w dowolnym typie nowotworu. Zmodyfikowane przeciwciała zostały zaprojektowane do niszczenia złośliwych komórek przy użyciu własnego układu odpornościowego pacjenta, poprzez połączenie endogennych limfocytów T z komórką nowotworową. Zmodyfikowane przeciwciała BiTE® pomagają połączyć limfocyt T z komórką docelową. Limfocyt T uwalnia substancje toksyczne, które prowadzą do śmierci komórki nowotworowej (apoptoza).
W Unii Europejskiej blinatumomab jest wskazany do stosowania w leczeniu osób dorosłych z nawrotową lub oporną na leczenie ALL z komórek prekursorowych linii B bez chromosomu Philadelphia oraz jest wskazany do stosowania w leczeniu osób dorosłych z ALL z komórek prekursorowych linii B bez chromosomu Philadelphia i z ekspresją antygenu CD19
w pierwszej lub drugiej całkowitej remisji ze stwierdzoną MRD większą lub równą 0,1%.
Źródło: inf. pras.