Możliwość udzielania przez Prezesa Urzędu porady naukowej jest instytucją nową, wprowadzoną do polskiego porządku prawnego ustawą z dnia 9 marca 2023 r. o badaniach klinicznych produktów leczniczych stosowanych u ludzi (Dz. U. poz. 605) w drodze nowelizacji przepisów ustawy z dnia 18 marca 2011 r. o Urzędzie Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
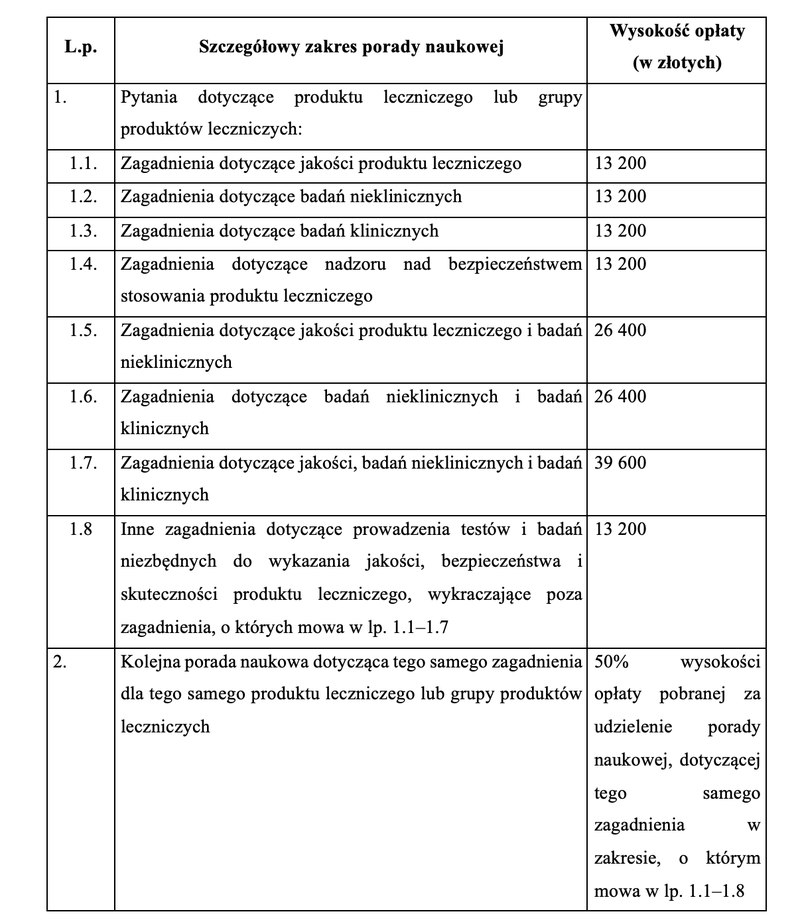
W załączniku nr 1 do rozporządzenia określono szczegółowy zakres udzielanych przez Prezesa Urzędu porad naukowych wraz z wysokością opłat określoną w odniesieniu do każdego z zakresów udzielanej porady. Określając wysokość opłat, uwzględniono nakład pracy związanej z udzieleniem porady i poziom kosztów ponoszonych przez Urząd. Określono także wzór wniosku o udzielenie porady naukowej w celu usprawnienia procedury związanej z jej udzieleniem.
Proponowane rozwiązania wzorowane są na doradztwie naukowym prowadzonym przez Europejską Agencję Leków (EMA), o którym mowa w rozporządzeniu (WE) nr 726/2004 Parlamentu Europejskiego i Rady z dnia 31 marca 2004 r. ustanawiającym unijne procedury wydawania pozwoleń dla produktów leczniczych stosowanych u ludzi i nadzoru nad nimi oraz ustanawiającego Europejską Agencję Leków.
Źródło: RCL