Rejestracja dotyczy stosowania leku u pacjentów, u których wystąpiła progresja choroby podczas lub po leczeniu chemioterapią na bazie platyny, lub u których wystąpiła progresja choroby w ciągu 12 miesięcy od neoadjuwantowej lub adjuwantowej terapii preparatami zawierającymi platynę.
Rejestracji dokonano w trybie przyspieszonym (FDA przyznała niwolumabowi priorytet oceny wniosku, a wcześniej nadała mu status terapii przełomowej) na podstawie badania klinicznego CheckMate 275, w którym obiektywny odsetek odpowiedzi na leczenie niwolumabem wyniósł 19,6 procent.
- Jako onkolog mogę stwierdzić, że blisko dwudziestoprocentowy odsetek odpowiedzi w zaawansowanym i przerzutowym raku pęcherza moczowego jest niezwykle zadowalający i klinicznie istotny w tej populacji pacjentów - powiedział dr. Jonathan E. Rosenberg z Memorial Sloan Kettering Cancer Center w Nowym Jorku.
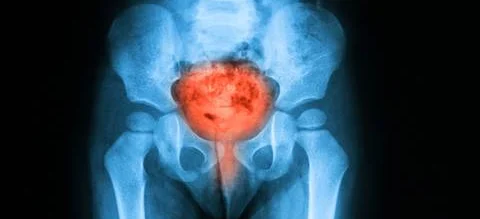
Rak pęcherza moczowego, który zazwyczaj powstaje z komórek wyścielających wnętrze pęcherza moczowego, jest piątym co do częstości diagnozowanym nowotworem w Stanach Zjednoczonych. Szacuje się, że w 2016 r. zarejestrowano 77 tys. nowych przypadków oraz ponad 16 tys. zgonów.
Rak urotelialny jest jednym z najczęstszych typów raka pęcherza moczowego, stanowiąc około 90 proc. diagnoz. Większość przypadków diagnozowana jest we wczesnym stadium, ale odsetek nawrotów i progresji choroby jest wysoki, około 50-70 proc. pacjentów doświadczy nawrotu choroby w ciągu 5 lat. Krótki czas trwania odpowiedzi pacjentów na leczenie w pierwszej linii, stanowi główne wyzwanie w leczeniu choroby z przerzutami, a opcje terapeutyczne leczenia zaawansowanego urotelialnego raka pęcherza moczowego w drugiej linii są ograniczone.
Źródło: PharmaDaily













![WUM_0004 [20230810]](https://cdn.medexpress.pl/media/images/WUM_0004_20230810.2e16d0ba.fill-491x272.format-webp.webp)
