Fot. Thinkstock / Getty Images[/caption]
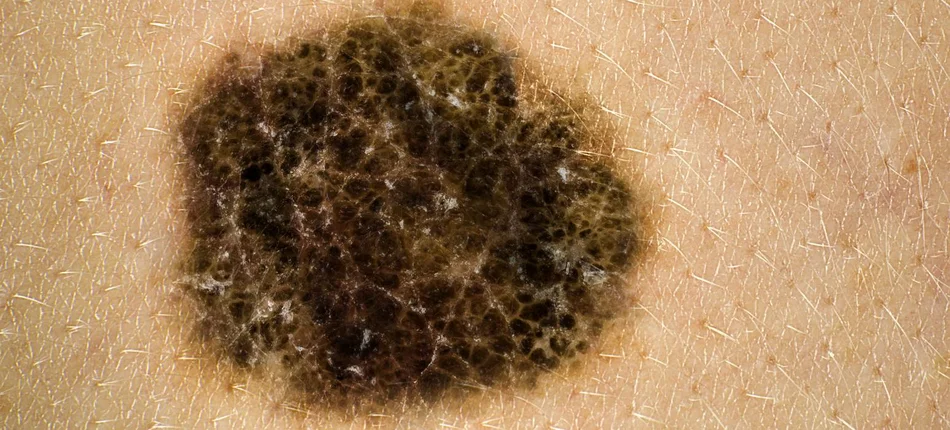
Fot. Thinkstock / Getty Images[/caption]Komisja Europejska zarejestrowała pembrolizumab do leczenia zaawansowanego (nieoperacyjnego lub przerzutowego) czerniaka u osób dorosłych.
Czerniak jest nowotworem o największej dynamice wzrostu liczby zachorowań. Liczba zachorowań w Polsce zwiększyła się w latach 1982-2002 niemal trzykrotnie. Pomimo wciąż względnie niskiej zapadalności na czerniaka mamy o 20 proc. wyższą śmiertelność niż wynosi europejska średnia. Każdego roku z powodu tego nowotworu umiera w naszym kraju ok. 600 mężczyzn i ok. 550 kobiet.
Pembrolizumab to przeciwciało anty-PD-1, aktywujące do walki z nowotworem układ odpornościowy pacjenta. Blokuje oni interakcję pomiędzy receptorem PD-1 i jego ligandami: PD-L1 oraz PD-L2, przywracając limfocytom zdolność do prawidłowej odpowiedzi immunologicznej, skutecznej reakcji organizmu na komórki nowotworowe.
Lek zarejestrowano na podstawie danych z badań klinicznych KEYNOTE-001, 002 i 006, przeprowadzonych z udziałem ponad 1500 pacjentów. Badania te miały ocenić skuteczność i bezpieczeństwo leczenia pembrolizumabem pacjentów z zaawansowanym czerniakiem w różnych sytuacjach terapeutycznych (wcześniejsze leczenie, czynniki prognostyczne, charakterystyka nowotworu oraz obecność lub brak mutacji BRAF).
Podczas badania leku odsetek odpowiedzi był tak korzystny, że jedno z badań klinicznych (KEYNOTE-006) zostało przerwane wcześniej. W badaniu tym porównywano dwa leki wykorzystujące dwa mechanizmy działające na odmienne szlaki immunologicznego punktu kontrolnego: PD-1 i CTLA-4. W tym badaniu pembrolizumab redukował ryzyko zgonu o ponad 30 procent w porównaniu z ipilimumabem (przeciwciałem anty-CTLA-4). Odsetek rocznych przeżyć po pembrolizumabie wyniósł 74 procent w grupie przyjmującej lek co dwa tygodnie oraz 68 procent w grupie przyjmującej lek co 3 tygodnie. W przypadku ipilimumabu odsetek ten wyniósł 58 procent.
Źródło: materiały prasowe