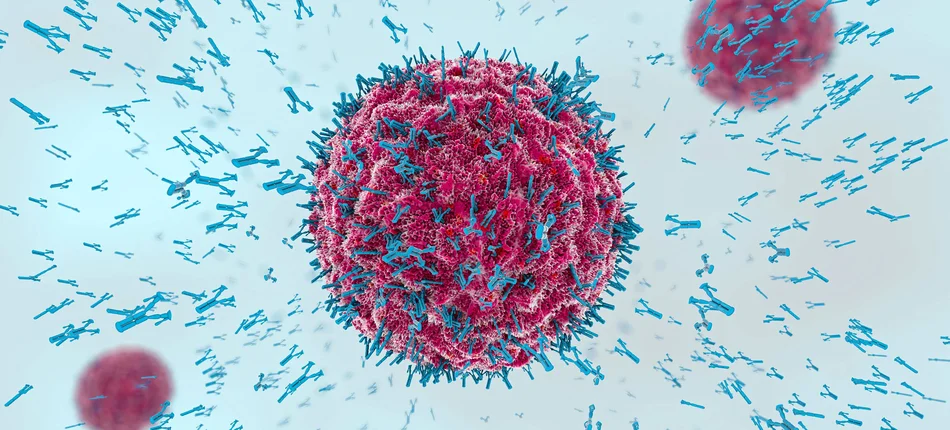
Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków (EMA) wydał pozytywną opinię dotyczącą rozszerzenia obecnego wskazania do stosowania blinatumomabu w monoterapii u dorosłych pacjentów z ostrą białaczką limfoblastyczną (ALL) z komórek prekursorowych linii B CD19 (+), bez chromosomu Philadelphia, będących w pierwszej lub drugiej remisji z minimalną chorobą resztkową (MRD), większą lub równą 0,1%.
Minimalna choroba resztkowa to pozostałe w organizmie komórki nowotworowe, pomimo tego, iż pacjent w ocenie konwencjonalnej uzyskał całkowitą remisję choroby. MRD można zmierzyć jedynie dzięki zastosowaniu bardzo czułych metod diagnostycznych, które wykrywają komórki nowotworowe w szpiku kostnym z czułością 1 komórka nowotworowa/10 000 komórek, natomiast czułość konwencjonalnej oceny mikroskopowej wynosi 1 komórka nowotworowa/ 20 komórek.
Uznanie statusu MRD jako możliwego do zaakceptowania punktu końcowego jest ważnym krokiem w zmianie sposobu leczenia ostrej białaczki limfoblastycznej, ponieważ podjęcie leczenia na wczesnym etapie rozwoju choroby daje większe szanse na eliminację komórek nowotworowych z organizmu.
Decyzja CHMP oparła się na danych z badania II fazy BLAST zarówno przy pierwszym rzucie choroby, jak również przy nawrotowej i opornej na leczenie ostrej białaczce limfoblastycznej. Jest to największe prospektywne badanie dotyczące choroby resztkowej w ALL jakie do tej pory przeprowadzono.
Badanie BLAST wykazało, że u 78% pacjentów w czasie jednego cyklu leczenia, zastosowanie blinatumomabu wiązało się z całkowitą odpowiedzią MRD, czyli brakiem wykrywalnej choroby resztkowej. Wyniki bezpieczeństwa wśród pacjentów z obecną minimalną chorobą resztkową były zgodne ze znanym profilem bezpieczeństwa blinatumomabu stosowanego u pacjentów z nawrotową lub oporną na leczenie białaczką limfoblastyczną z komórek prekursorowych linii B.
W marcu 2018 r. Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła blinatumomab w leczeniu dorosłych i dzieci z ostrą białaczką limfoblastyczną, z komórek prekursorowych linii B, w pierwszej lub drugiej remisji z MRD większą lub równą 0,1%.
Blinatumomab jest pierwszą immunoterapią firmy Amgen stworzoną w technologii BiTE®, która w innowacyjny sposób wspomaga układ odpornościowy w walce z komórkami nowotworowymi.
Opinia CHPM jest dostępna tutaj.
Źródło: Inf. pras.