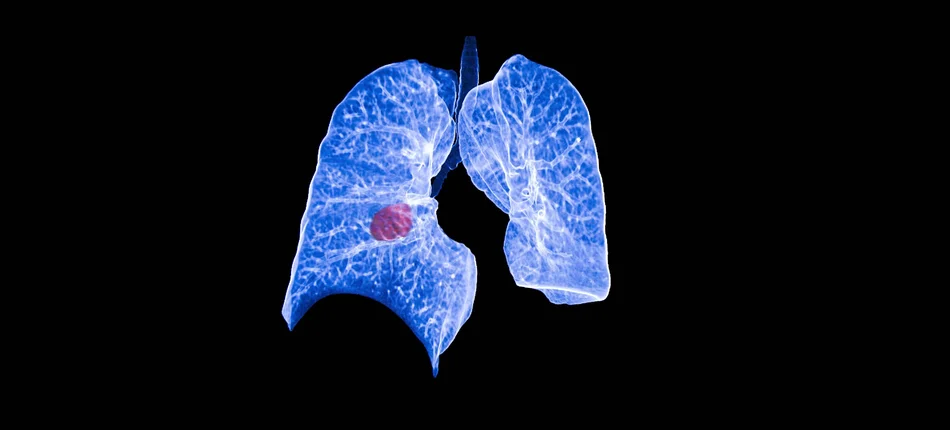
Zgoda Komisji Europejskiej dotyczy stosowania brygatynibu w monoterapii dorosłych pacjentów z zaawansowanym niedrobnokomórkowym rakiem płuca (NDRP) z obecnością rearanżacji w genie ALK (ALK+), leczonych wcześniej kryzotynibem. Decyzję tę podjęto w oparciu o pozytywną opinię Komitetu ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP).
– Wprowadzenie terapii celowanych znacznie poprawiło skuteczność leczenia ALK+ NDRP, jednak dla około 70 procent pacjentów, u których występuje progresja choroby podczas leczenia kryzotynibem, w tym przerzuty do mózgu, potrzebne są dodatkowe opcje terapeutyczne – powiedziała dr Enriqueta Felip, kierownik Oddziału Onkologii Klatki Piersiowej Kliniki Onkologicznej Szpitala Uniwersytetu Vall d’Hebron w Barcelonie.
– Dane z badania ALTA oceniającego brygatynib wykazały długotrwałą ogólnoustrojową i wewnątrzczaszkową skuteczność, jak też korzystny profil bezpieczeństwa – uzyskano najdłuższy czas przeżycia bez progresji choroby oraz całkowity czas przeżycia opisany u takich pacjentów. Rejestracja ta daje lekarzom w Unii Europejskiej kolejną opcję leczenia pacjentów z ALK+ NDRP leczonych wcześniej kryzotynibem – tłumaczy dr Felip.
– Wiele osób nie ma wiedzy na temat ALK+ NDRP i jego specyfiki oraz faktu, że ten rodzaj raka płuc wykazuje tendencję do występowania u osób w młodszym wieku oraz że nie jest on związany z paleniem tytoniu – powiedziała Stefania Vallone, President, Lung Cancer Europe – Ci pacjenci często są młodzi, mają rodziny, koncentrują się na swojej karierze i wnoszą wkład w życie swoich społeczności. Dostępność nowej terapii, wydłużającej czas bez progresji choroby jest bardzo ważna i nie można jej lekceważyć.
Zgoda Komisji Europejskiej opiera się na danych z międzynarodowego badania fazy 2 ALTA, w którym pacjentów randomizowano do grupy otrzymujących jeden z dwóch schematów dawkowania brygatynibu: 90 mg raz na dobę (n=112) lub zalecany obecnie schemat dawkowania 180 mg raz na dobę z siedmiodniowym okresem wstępnym z zastosowaniem dawki 90 mg raz na dobę (n=110).
Wyniki wykazały, że wśród pacjentów, którzy otrzymywali zalecany schemat dawkowania, odsetek odpowiedzi obiektywnych (ORR) wyniósł 56 procent, a mediana czasu trwania odpowiedzi (DOR) wynosiła 15,7 miesiąca, zgodnie z oceną niezależnej komisji weryfikacyjnej (IRC). W tej grupie wykazano również, że mediana czasu przeżycia bez progresji choroby (PFS) wynosiła 16,7 miesiąca według oceny IRC, a mediana całkowitego czasu przeżycia wynosiła 34,1 miesiąca w przypadku pacjentów z miejscowo zaawansowanym lub przerzutowym ALK+ NDRP, u których wystąpiła progresja choroby podczas leczenia kryzotynibem.
Najczęstszymi działaniami niepożądanymi (≥25%) zaobserwowanymi u pacjentów leczonych brygatynibem według zalecanego schematu dawkowania 180 mg były: zwiększona aktywność aminotransferazy asparaginianowej (AST), hiperglikemia, hyperinsulinemia, niedokrwistość, zwiększona aktywność fosfokinazy kreatynowej (CPK), nudności, podwyższony poziom lipazy, zmniejszona liczba limfocytów, zwiększona aktywność aminotransferazy alaninowej (ALT), biegunka, zwiększone stężenie amylazy, uczucie zmęczenia, kaszel, bóle głowy, zwiększona aktywność fosfatazy alkalicznej, hypofosfatemia, nieprawidłowo wydłużony czas częściowej tromboplastyny po aktywacji (APTT), wysypka, wymioty, duszność, nadciśnienie tętnicze, zmniejszona liczba krwinek, bóle mięśni i neuropatia obwodowa.
Z kolei najczęstszymi ciężkimi działaniami niepożądanymi (≥2 procent) zaobserwowanymi u pacjentów leczonych brygatynibem według zalecanego schematu dawkowania, innymi niż zdarzenia związane z progresją choroby nowotworowej, były: infekcyjne i nieinfekcyjne zapalenie płuc oraz duszność.
Źródło: inf. pras.