Nowy lek biologiczny dla chorych na RZS

Opublikowano 9 czerwca 2017 14:27
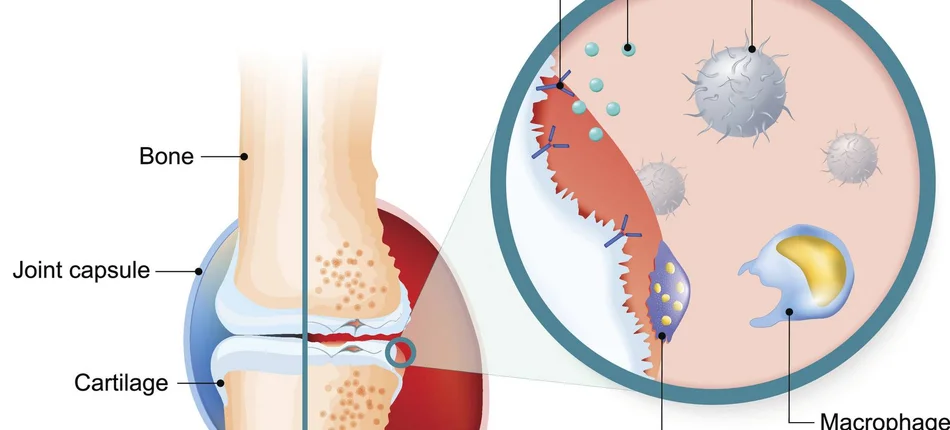
RZS to przewlekła choroba autoimmunologiczna - układ odpornościowy atakuje tkanki stawów, powodując stan zapalny, ból, a ostatecznie uszkodzenie stawów i niepełnosprawność pacjenta. RZS dotyka około 1,3 miliona Amerykanów, przy czym 75 procent tej grupy stanowią kobiety. Choroba najczęściej pojawia się u osób w wieku od 30 do 60 lat, ale może wystąpić u dorosłych w każdym wieku.
Amerykańska Agencja ds. Żywności i Leków (FDA) dopuściła sarilumab do stosowania w terapii dorosłych pacjentów z aktywnym reumatoidalnym zapaleniem stawów (RZS) o nasileniu umiarkowanym do ciężkiego, z niewystarczającą odpowiedzią na co najmniej jeden preparat z grupy leków modyfikujących przebieg choroby (DMARD), takich jak metotreksat (MTX) lub z nietolerancją leków z tej grupy.
Sarilumab to ludzkie przeciwciało monoklonalne łączące się z receptorem interleukiny 6 (IL-6R), cytokiny, której nadmierna ilość może z czasem przyczyniać się do rozwoju stanu zapalnego związanego z RZS.
– Badania kliniczne wykazały, że sarilumab powoduje złagodzenie objawów subiektywnych i obiektywnych RZS oraz poprawę sprawności ruchowej, a także znaczne ograniczenie progresji radiologicznej zaburzeń strukturalnych typowych dla tego schorzenia – tłumaczy dr Alan Kivitz z Altoona Center for Clinical Research i Altoona Arthritis and Osteoporosis Center, badacz w światowym programie badań klinicznych sarilumabu SARIL- RA. – To ważne, ponieważ nie wszystkie dostępne obecnie metody leczenia są skuteczne u wszystkich pacjentów, a pod względem mechanizmu działania sarilumab różni się od większości najczęściej stosowanych leków biologicznych, takich jak leki należące do klasy anty-TNF, dzięki czemu otwiera przed pacjentami i ich lekarzami nowe możliwości.
Sarilumab można stosować w monoterapii lub w skojarzeniu z MTX lub z innymi lekami konwencjonalnymi z grupy DMARD. Zalecana dawka wynosi 200 mg raz na dwa tygodnie, w postaci iniekcji podskórnej, którą pacjent może wykonywać samodzielnie.
FDA podjęła decyzję o rejestracji sarilumabu na podstawie wyników dwóch kluczowych badaniach klinicznych 3 fazy (MOBILITY oraz TARGET), w których wykazano, że przeciwciało powodowało statystycznie istotną klinicznie poprawę u pacjentów z aktywnym RZS.
Wcześniej lek został dopuszczony do obrotu w Kanadzie. W Europie sarilumab uzyskał w kwietniu br. pozytywną rekomendację Komitetu ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków.
Źródło: materiały prasowe