Nowy lek dla chorych na łuszczycę

Opublikowano 23 lutego 2017 15:11
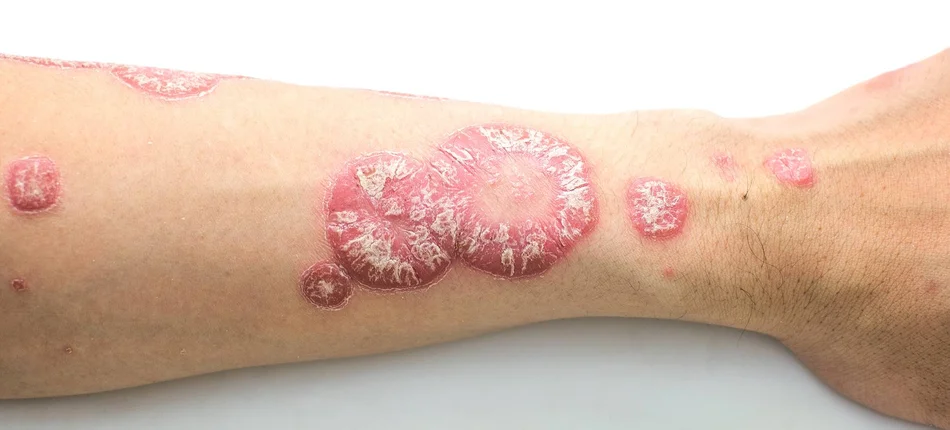
Podawany drogą iniekcji brodalumab przeznaczony jest dla pacjentów z łuszczycą plackowatą o nasileniu od umiarkowanego do ciężkiego, u których nie udało się uzyskać zadowalającej odpowiedzi na inne terapie ogólnoustrojowe lub fototerapię.
– Łuszczyca plackowata może powodować nasilone podrażnienie skóry, stanowiące znaczący dyskomfort dla chorego. Rejestracja brodalumabu zapewnia nową opcję terapeutyczną. Płynące z niej korzyści i potencjalne zagrożenia powinny być szczegółowo przeanalizowane przez lekarza wspólnie z pacjentem – powiedziała dr Julie Beitz, dyrektor III Biura Oceny Leków (Office of Drug Evaluation III) w FDA.
Skuteczność i bezpieczeństwo brodalumabu zbadano w trzech randomizowanych, zaślepionych badaniach klinicznych, które objęły łącznie 4373 dorosłych chorych. Wyniki tych badań pokazały znaczącą przewagę brodalumabu nad placebo.
W czasie trwania badań klinicznych wśród jego uczestników odnotowano epizody myśli i zachowania samobójcze (w tym także zakończone zgonem). Były one częstsze u osób, które w przeszłości doświadczały depresji i miewały myśli samobójcze.
Choć nie ma dowodów na przyczynowo-skutkowy związek pomiędzy przyjmowaniem brodalumabu a wzrostem ryzyka samobójstwa, lek będzie na razie dostępny tylko w ramach specjalnego programu - „Siliq Risk Evaluation and Mitigation Strategy”.
Źródło: FDA/PharmaDaily