 ThinkstockPhotos[/caption]
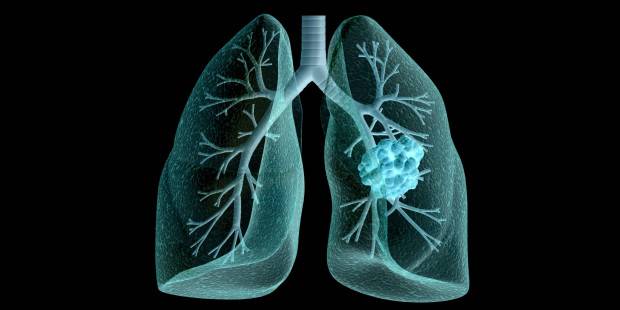
ThinkstockPhotos[/caption]Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) przy Europejskiej Agencji Leków (EMA) wydał pozytywną opinię w sprawie dopuszczenia niwolumabu do stosowania u chorych na zaawansowanego płaskonabłonkowego niedrobnokomórkowego raka płuc (NDRP).
Rak płuca, wg danych Światowej Organizacji Zdrowia, jest każdego roku powodem 1,5 mln zgonów. Jest też główną przyczyną śmierci z powodu chorób nowotworowych. Niedrobnokomórkowy rak płuca stanowi około 85 proc. wszystkich przypadków nowotworu płuca. Globalny wskaźnik przeżycia pięcioletniego w NDRP w I stadium zaawansowania wynosi od 47 do 50 proc. , a w przypadku NDRP w IV stadium zaawansowania wskaźnik przeżycia pięcioletniego spada do 2 proc.
Niwolumab jest pierwszym inhibitorem immunologicznego punktu kontrolnego PD-1, który uzyskał pozytywną opinię CHMP w leczeniu zaawansowanego niedrobnokomórkowego raka płuc. Opinia CHMP dotyczy terapii miejscowo zaawansowanego lub przerzutowego NDRP u dorosłych pacjentów po wcześniejszej chemioterapii. Została ona wydana na podstawie danych z dwóch badań klinicznych CheckMate-017 i CheckMate-063, które wykazały skuteczność i bezpieczeństwo niwolumabu u pacjentów z zaawansowanym lub przerzutowym NDRP po progresji występującej po wcześniejszej chemioterapii.
CheckMate-017 było otwartym, randomizowanym badaniem III fazy, do którego włączono pacjentów z progresją choroby w trakcie lub po wcześniejszym zastosowaniu chemioterapii opartej na dwulekowym schemacie zawierającym pochodne platyny. Wyniki badania wykazały znaczne zwiększenie całkowitego przeżycia w grupie chorych leczonych niwolumabem w porównaniu z docetakselem, z 41-proc. redukcją ryzyka zgonu. Szacowane roczne przeżycia były prawie dwukrotnie większe w grupie pacjentów leczonych niwolumabem (42 proc.) niż docetaxelem (24 proc.).
Drugie badanie – CheckMate-063 – było międzynarodowym, wieloośrodkowym badaniem II fazy z pojedynczym ramieniem obejmującym pacjentów z przerzutowym płaskonabłonkowym NDRP, z progresją po terapii opartej na pochodnych platyny oraz po co najmniej jednym dodatkowym leczeniu systemowym. Potwierdzony odsetek obiektywnych odpowiedzi (pierwszorzędowy punkt końcowy badania) wynosił 14,5 proc. z szacowanym rocznym przeżyciem 40,8 proc. i medianą całkowitego przeżycia 8,2 miesiąca.
Opinia CHMP zostanie zweryfikowana przez Komisję Europejską, która ma uprawnienia do dopuszczenia leków do obrotu w Unii Europejskiej (UE).
Źródło: materiały prasowe












![WUM_0004 [20230810]](https://cdn.medexpress.pl/media/images/WUM_0004_20230810.2e16d0ba.fill-491x272.format-webp.webp)

