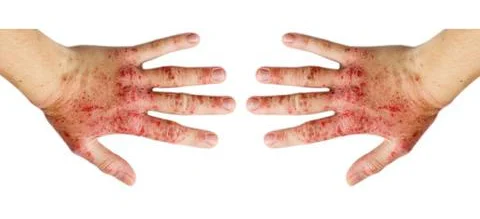
Atopowe zapalenie skóry (AZS) to przewlekła choroba zapalna charakteryzująca się swędzeniem i zmianami zapalnymi skóry, które mogą występować na dowolnej części ciała. Na AZS choruje około 7–8 mln dorosłych w USA i 1–3 proc. dorosłych na całym świecie.
U około 70 proc. osób z atopowym zapaleniem skóry w wywiadzie rodzinnym występują inne częste choroby atopowe, np. astma lub katar sienny. Nasilone swędzenie, drapanie się i uszkodzenia skóry związane z chorobą mogą niekiedy prowadzić do zakażeń powodowanych przez bakterie, takie jak Staphylococcus aureus. Dodatkowo objawy somatyczne choroby mogą prowadzić do lęku, depresji i poczucia izolacji społecznej
Na podstawie badania ankietowego z udziałem 200 lekarzy szacuje się, że w USA żyje około 1,6 miliona pacjentów z tą chorobą, która została rozpoznana i jest leczona, jednak pozostaje niekontrolowana i ma nasilenie umiarkowane lub ciężkie.
Do badań LIBERTY AD SOLO 1 i SOLO 2 włączono ogółem 1379 dorosłych pacjentów z umiarkowanym lub ciężkim AZS. Pacjentów włączano do badania, gdy nie uzyskiwano u nich skutecznej kontroli choroby w wyniku stosowania leków miejscowych lub gdy ich stosowanie nie było zalecane ze względów medycznych.
Wszystkich pacjentów oceniano według 5-punktowej skali ogólnej oceny przez badacza (Investigator’s Global Assessment, IGA), w zakresie od 0 punktów (brak zmian) do 4 punktów (ciężkie zmiany). Kryteria włączenia obejmowały wymóg wyjściowej oceny 3 lub 4 punktów.
Pacjentów oceniano również z użyciem wskaźnika powierzchni i nasilenia wyprysku (Eczema Area and Severity Index, EASI) oraz innych miar.
Badanych przydzielono w sposób losowy do jednej z trzech grup terapeutycznych: grupy otrzymującej dupilumab w dawce 300 mg podskórnie raz na tydzień, grupy otrzymującej ten lek w dawce 300 mg podskórnie co dwa tygodnie lub grupy otrzymującej placebo przez 16 tygodni po podaniu początkowej dawki nasycającej dupilumabu 600 mg podskórnie lub początkowej dawki placebo.
Po 16 tygodniach uzyskano następujące wyniki:
- W badaniach SOLO 1 i SOLO 2 odpowiednio u 37 i 36 proc. pacjentów, którzy otrzymywali dupilumab w dawce 300 mg raz na tydzień i u 38 proc. i 36 proc. pacjentów, którzy otrzymywali dupilumab w dawce 300 mg co dwa tygodnie, uzyskano całkowite lub prawie całkowite ustąpienie zmian skórnych (IGA 0 lub 1), w porównaniu z 10 i 8,5 proc. pacjentów otrzymujących placebo. Był to pierwszorzędowy punkt końcowy badania dla USA.
- W badaniach SOLO 1 i SOLO 2 procentowa poprawa wskaźnika EASI w stosunku do stanu wyjściowego wynosiła odpowiednio 72 i 69 proc. u pacjentów, którzy otrzymywali dawkę 300 mg podawaną raz na tydzień i 72 proc. i 67 proc. u pacjentów, którzy otrzymywali dupilumab w dawce 300 mg co dwa tygodnie, wobec 38 proc. i 31 proc. pacjentów otrzymujących placebo.
- W badaniach SOLO 1 i SOLO 2 odpowiednio u 52,5 proc. i 48 proc. pacjentów, którzy otrzymywali dupilumab w dawce 300 mg raz na tydzień i u 51 proc. i 44 proc. pacjentów, którzy otrzymywali dupilumab w dawce 300 mg co dwa tygodnie, uzyskano wskaźnik EASI-75, w porównaniu z 15 proc. i 12 proc. pacjentów otrzymujących placebo (p < 0,0001). Był to najważniejszy drugorzędowy punkt końcowy tych badań dla USA i jeden z pierwszorzędowych punktów końcowych dla Unii Europejskiej.
W przypadku 16-tygodniowego okresu leczenia ogólna częstość występowania zdarzeń niepożądanych (65–73 proc. po stosowaniu dupilumabu i 65–72 proc. po stosowaniu placebo) była porównywalna pomiędzy grupami otrzymującymi dupilumab i grupami otrzymującymi placebo.
Amerykańska Agencja ds. Żywności i Leków (FDA) przyznała dupilumabowi status terapii przełomowej w AZS w listopadzie 2014 r. Dupilumab jest obecnie poddawany badaniom klinicznym, a bezpieczeństwo i skuteczność jego stosowania nie zostały jeszcze w pełni ocenione przez żaden urząd rejestracyjny.
Źródło: materiały prasowe