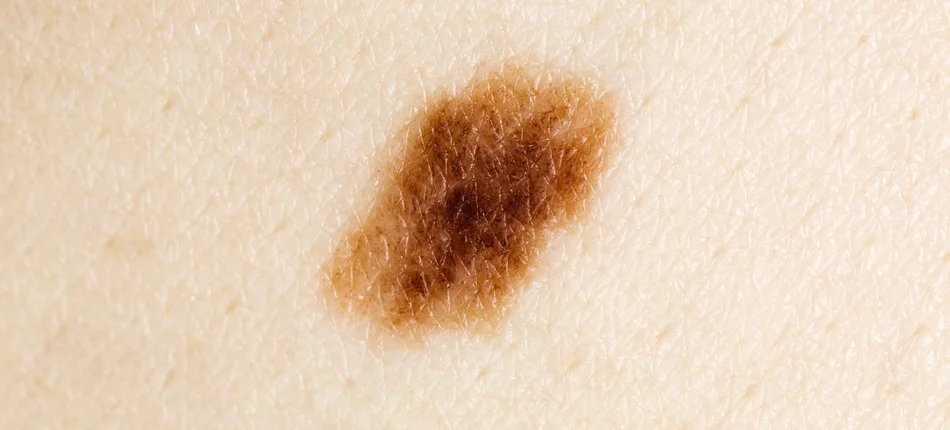
Czerniak jest nowotworem skórnym charakteryzującym się niekontrolowanym wzrostem znajdujących się w skórze komórek wytwarzających pigment (melanocytów).
Czerniak przerzutowy jest najbardziej śmiertelną postacią choroby, występuje wtedy, gdy nowotwór ulegnie rozsiewowi poza powierzchnię skóry na inne narządy, takie jak węzły chłonne, płuca, mózg lub inne obszary ciała. Czerniak zajmuje dziewiąte miejsce wśród innych nowotworów pod względem liczby zachorowań w Europie. Szacuje się, że co roku w Europie rozpoznaje się 100 tys. nowych zachorowań na czerniaka a ponad 20 tys. umiera z jego powodu.
Decyzja KE oznacza dopuszczenie skojarzonego schematu (niwolumab + ipilimumab) leczenia zaawansowanego czerniaka z wykorzystaniem immunoterapii na terenie wszystkich 28 państw Unii Europejskiej.
Połączenie niwolumabu i ipilimumabu stanowi pierwszą i jedyną zatwierdzoną kombinację dwóch cząsteczek immunokompetentnych na terenie Unii Europejskiej. Decyzja opiera się na wynikach badania III fazy CheckMate 067.
Wcześniej, w kwietniu 2016 stosowanie niwolumabu w skojarzeniu z ipilimumabem w leczeniu zaawansowanego (nieoperacyjnego lub przerzutowego) czerniaka u dorosłych zarekomendował Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) przy Europejskiej Agencji Leków.
Komitet poinformował też, że wydłużenie przeżycia bez progresji choroby (PFS) dla kombinacji niwolumabu z ipilimumabem potwierdzono jedynie u pacjentów z niską ekspresją PD-L1 w stosunku do monoterapii niwolumabem. CHMP pozytywną opinię wydał na podstawie danych z dwóch badań klinicznych – CheckMate-067 i CheckMate-069.
Niwolumab w monoterapii został już dopuszczony przez KE do stosowania w leczeniu zaawansowanego czerniaka i leczonego wcześniej zaawansowanego niedrobnokomórkowego raka płuca (NDRP) oraz raka nerkowokomórkowego.
Źródło: materiały prasowe