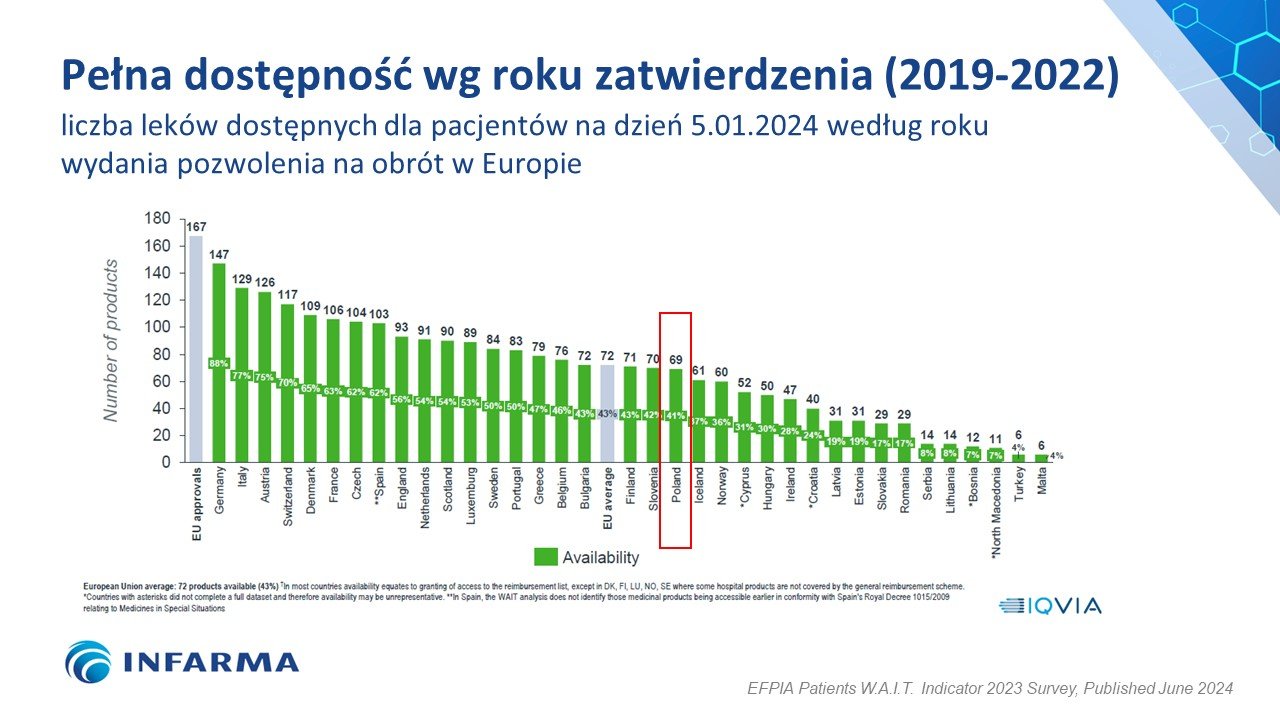
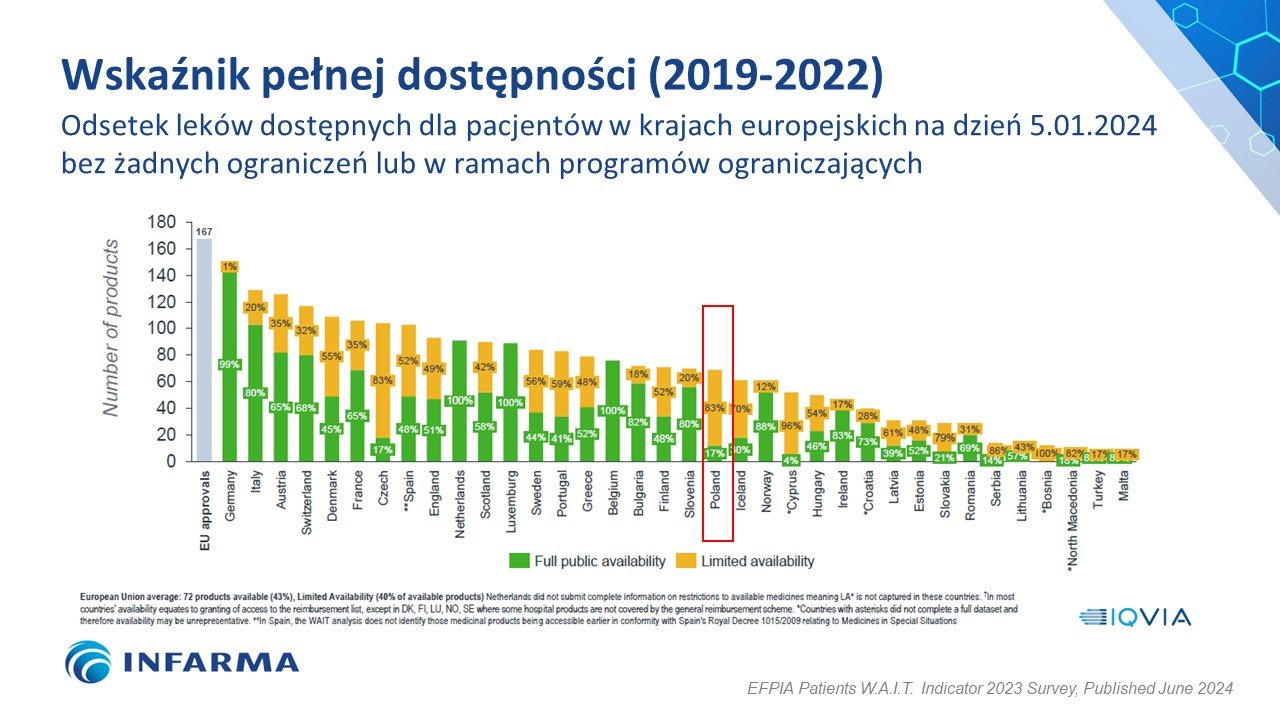
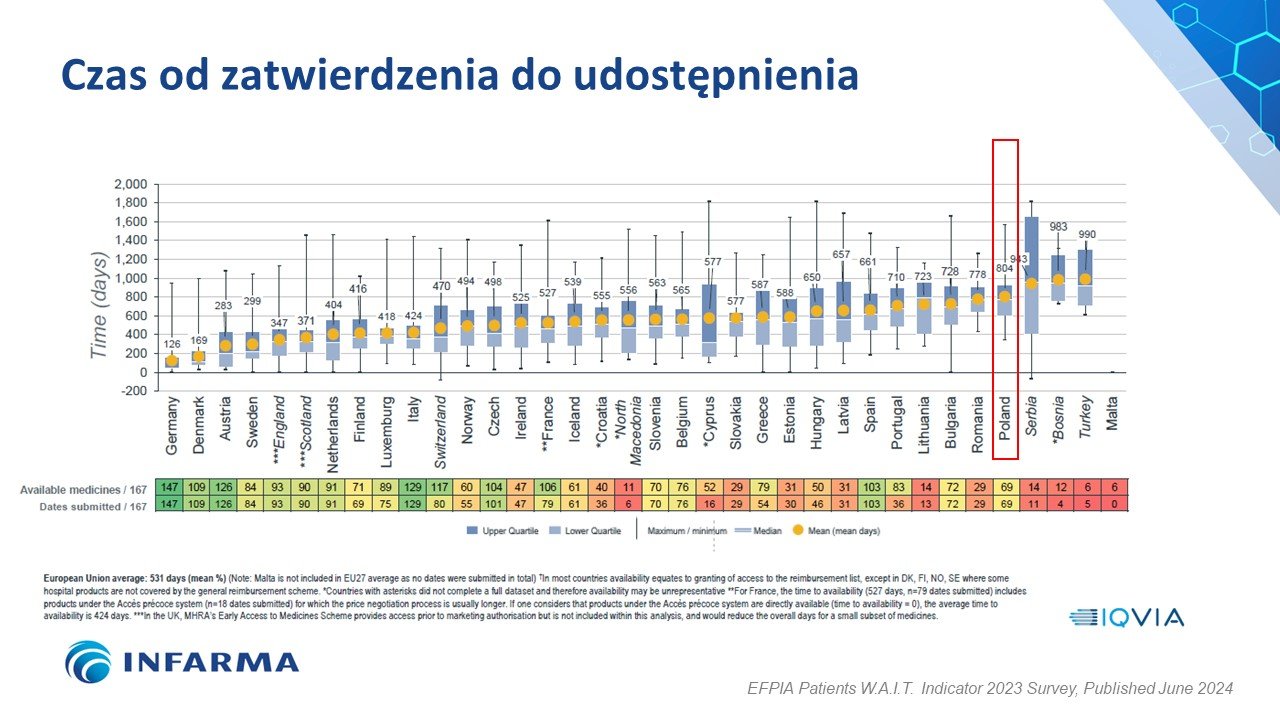
Polska ponownie poprawiła swój wynik w badaniu W.A.I.T. pod względem dostępności do innowacyjnych leków, awansując o jedno miejsce i plasując się na 20. pozycji wśród 36 badanych państw europejskich z wynikiem na poziomie 41 proc. dostępnych terapii. Od średniej europejskiej, która wynosi 43 proc., dzieli nas dystans dwóch krajów – Słowenii (42 proc.) i Finlandii (43 proc.). Przypomnijmy, że rok temu Polska awansowała z 25. na 21. miejsce z wynikiem 36 proc. Dziś w Polsce refundowanych jest 69 ze 167 innowacyjnych technologii lekowych, jednak aż 83 proc. z nich jest refundowanych jedynie dla ograniczonej grupy pacjentów. Jest to wynik gorszy niż rok temu aż o 5 p.p., kiedy ograniczenia były na poziomie 78 proc. Skrócił się natomiast czas od rejestracji do refundacji – z 827 dni rok temu do 804 dni w obecnym badaniu, ale nadal jest to jeden z najgorszych wyników a w całym zestawieniu. Za nami są tylko 4 kraje – Serbia, Bośnia, Turcja i Malta.
Polska awansuje o jedno „oczko”
Polska sukcesywnie poprawia swój wynik w badaniu W.A.I.T. (Waiting to Access Innovative Therapies), które w tym roku obchodzi okrągłą 20. rocznicę. To największa analiza dostępu do innowacyjnych leków i miernik czasu oczekiwania na nie w krajach europejskich. Wyniki badania publikowane są od 2004 r. przez Europejską Federację Przemysłu i Stowarzyszeń Farmaceutycznych. Historyczny awans Polska zanotowała w ubiegłorocznym zestawieniu – przesunęliśmy się z 25. na 21. miejsce. Wówczas w naszym kraju refundowanych było 59 na 168 terapii. W tym roku z 69 na 167 refundowanymi terapiami zajmujemy 20. miejsce wśród 36 państw europejskich. Podium jest bez zmian – liderem ze 147 dostępnymi terapiami pozostają Niemcy, a tuż za nimi Włochy (129) i Austria (126). Polska wyprzedza m.in. Węgry i Słowację, ale przykładowo inny nasz sąsiad – Czechy zajmują w zestawieniu W.A.I.T. wysoką, aż 7. pozycję.
– Dostęp do innowacyjnych technologii lekowych w Polsce poprawia się. Podobnych informacji dostarczyły nam ogłoszone w maju aktualne dane platformy Access GAP, w ramach której analizujemy dostęp do innowacyjnych terapii i rozwiązań diagnostycznych w krajach Grupy Wyszehradzkiej. Zgodnie z nimi Czechy również znacznie wyprzedzają odpowiednio Słowację, Polskę i Węgry. Dobry wynik Polski w zestawieniu W.A.I.T. to dowód na to, że idziemy w dobrym kierunku i dzięki pozytywnym decyzjom refundacyjnym nadrabiamy opóźnienia w zakresie dostępu polskich pacjentów do innowacyjnych terapii. Szczegółowa analiza wyników W.A.I.T. pokazuje jednocześnie, że w Polsce wciąż do refundacji wchodzą częściej leki starsze. Spośród 69 leków objętych analizą W.A.I.T., które są refundowane w Polsce, tylko 8 miało rejestrację w 2022 roku, a pozostałe we wcześniejszych latach. To sprawia, że nie wykorzystujemy w pełni potencjału innowacyjności, a z nowych leków polscy pacjenci korzystają, gdy… przestają one już być nowe – mówi Michał Byliniak, Dyrektor Generalny Związku Innowacyjnych Firm Farmaceutycznych INFARMA.
W Polsce dostępnych jest więcej leków, ale… z większymi ograniczeniami
Aż o 5 punktów procentowych zwiększył się odsetek leków refundowanych w Polsce z ograniczeniami dla określonych grup pacjentów. Obecnie wynosi on aż 83 proc. (w ubiegłorocznym zestawieniu było to 78 proc.) a gorszy wynik od Polski ma tylko Cypr (96 proc.) i Bośnia (100 proc.). Dla porównania w Słowenii proporcje są dokładnie odwrotne – 80 proc. leków jest dostępnych bez ograniczeń a tylko 20 proc. dla określonych grup pacjentów.
– Każdy awans Polski w zestawieniach dotyczących dostępu pacjentów do innowacyjnych terapii cieszy a równocześnie skłania do analizy wskaźników, wymagających poprawy. W badaniu W.A.I.T. niepokoi zwłaszcza odsetek leków refundowanych dla określonych grup pacjentów, który dla Polski jest ekstremalnie wysoki i zupełnie odstaje od standardów europejskich. Oznacza to, że tylko część pacjentów, którzy mogą odnieść korzyść z zastosowania danej terapii ma do niej dostęp. Terapia jest więc zarejestrowana w Polsce, niemalże na wyciągnięcie ręki, lecz… w praktyce dla wielu pacjentów niedostępna. Słusznym kierunkiem zmian powinno być zatem zapewnienie polskim pacjentom pełniejszego dostępu do innowacji medycznych, a tym samym wyrównywanie szans na dłuższe i lepszej jakości życie chorych – podkreśla Agnieszka Grzybowska-Zalewska, Prezes Zarządu Związku Pracodawców Innowacyjnych Firm Farmaceutycznych INFARMA
25 spośród 69 dostępnych w Polsce innowacyjnych technologii lekowych to leki onkologiczne.
Aż 92 proc. z nich refundowane są dla ograniczonej grupy pacjentów. Podobnie sytuacja wygląda
w chorobach rzadkich, gdzie mamy 20 leków, spośród których 95 proc. jest refundowana z ograniczeniami i w chorobach rzadkich nieonkologicznych, gdzie dostępnych jest 14 terapii, ale 93 proc. z ograniczeniami.
Więcej terapii z ograniczeniami i późno dostępnych z powodu wielu barier
Polska nieznacznie poprawiła wynik pod względem czasu oczekiwania polskich pacjentów na refundację od momentu jego rejestracji. W poprzednim roku było to 827 dni, dziś 804 czyli 23 dni krócej. Na innowacyjne leki ratujące zdrowie i życie dłużej czekają jedynie pacjenci w Serbii, Bośni i Turcji. Wyprzedza nas m.in. Rumunia oraz Bułgaria, nie zbliżamy się nawet do pozostałych państw grupy Wyszehradzkiej (Czechy: 498 dni, Słowacja: 577 dni, Węgry: 650 dni). Dla porównania pacjent w Niemczech może być beneficjentem nowej terapii już po 126 dniach od jej rejestracji, w Danii po 169 dniach a w Austrii po 283.
Wskaźnik W.A.I.T. pokazuje, że utrzymują się różnice w czasie potrzebnym pacjentom na uzyskanie dostępu do innowacyjnych leków, w związku z czym pacjenci w jednym kraju europejskim mogą czekać na te same leki ponad 6 razy dłużej niż pacjenci w kraju sąsiednim.
Przyczyny niedostępności i opóźnień, zbadane w raporcie opracowanym przez Charles River Associates (CRA) są wieloczynnikowe. Nawet zanim lek zostanie zatwierdzony w Europie, powolne procesy regulacyjne mogą wydłużyć czas potrzebny na dotarcie nowych leków do pacjentów.
Opóźnienia i bariery w dostępie są często spowodowane kombinacją czynników. Na przykład, szybkość oceny technologii medycznych, różne procesy refundacyjne lub dodatkowe warstwy regionalnych i lokalnych procesów decyzyjnych. Powielające się lub niespójne wymagania dotyczące dowodów mogą również powodować opóźnienia lub brak dostępności. Na przykład, różne kraje, organy HTA i płatnicy mogą wymagać różnych punktów końcowych badań lub niektórzy akceptują rzeczywiste dowody, podczas gdy inni nie.
Stosowanie zewnętrznych cen referencyjnych (ERP) również powoduje opóźnienia i brak dostępności. Wiele krajów nie rozpoczyna krajowych procesów ustalania cen i refundacji, dopóki nie uzyska dostępu do decyzji refundacyjnych z kilku innych krajach europejskich.
Co więcej dane z prowadzonego przez EFPIA European Access Hurdles Portal pokazują, że większość (71 proc.) całkowitego czasu między zatwierdzeniem przez EMA a refundacją ma miejsce po złożeniu wniosku o wycenę i refundację (P&R). Pozostałe 29 proc. przypada na czas przed złożeniem wniosku o P&R.
– Powody, dla których Europejczycy muszą czekać na dostęp do nowych leków są prawie zawsze kombinacją wielu czynników. Różnią się one w zależności od obszaru terapii i kraju. Dlatego też kwestie dostępu nie mogą zostać rozwiązane za pomocą unijnego prawodawstwa w zakresie innowacji, ale wymagają działań ze strony wielu podmiotów, w tym państw członkowskich, w celu osiągnięcia postępu. Niezależnie od przyczyny, jesteśmy gotowi odegrać naszą rolę w skróceniu czasu potrzebnego pacjentom na uzyskanie dostępu do leków, które odkrywamy, opracowujemy i dostarczamy – podkreśla Nathalie Moll, Dyrektor Generalna EFPIA.
Podobne bariery i konieczność działania na poziomie krajowym dostrzega INFARMA, która od dawna zwraca uwagę Ministerstwa Zdrowia na zmiany legislacyjne, które są konieczne by odwrócić ten negatywny trend, przypominając je w odpowiedzi na komunikat MZ w ostatnim piśmie.
– Na podstawie naszych analiz oraz wyników raportów opracowanych przez EFPIA wydaje się oczywiste, że sprowadzenie problemu zbyt długiego czasu oczekiwania pacjentów na refundację do kwestii momentu złożenia przez firmy wniosku o refundację jest ogromnym uproszczeniem, które nie przybliża nas do rozwiązania tego problemu. Polska ma najdłuższy czas oczekiwania w UE i wydaje się, że jest to moment by zadać sobie pytanie, czy strategia oparta na założeniu, że chcemy mieć wszystko, szybko i najtaniej przy systematycznie oddalającym się od ustawowych 17 proc. CBR jest podejściem efektywnym i przede wszystkim dobrym dla pacjentów. Bariery są liczne i bardzo złożone a potrzebne zmiany w procesie refundacji przedstawiliśmy szczegółowo w piśmie do Ministerstwa Zdrowia, co spotkało się z szybką reakcją i – co nas bardzo cieszy – obecnie jesteśmy w trakcie rozmów na ten temat – mówi Michał Byliniak, Dyrektor Generalny INFARMA.
Proces wnioskowania o refundację i ustalenie ceny leku w Polsce, jak wynika z doświadczeń firm zrzeszonych w INFARMIE, jest jednym z najbardziej kosztownych tego typu postepowań w Europie (koszty przygotowania analiz HTA, opłaty za złożenie wniosków, opłata za przygotowanie analizy weryfikacyjnej, koszty związane z koniecznością wypełnienia warunku dostępności produktu w obrocie itd.). Jednocześnie jest to postępowanie niezwykle złożone i prowadzone w środowisku prawnym nieprzewidywalnym co do efektu postępowania, destabilizującym decyzje po ich wydaniu, nakładającym na wnioskodawców zbędne, a jak pokazuje ostatnia nowelizacja ustawy – nawet irracjonalne i niewykonalne zobowiązania pod rygorem licznych kar.
Zarówno branża innowacyjna jak i decydenci w UE od dawna dostrzegają ten problem i podejmują inicjatywy, które mają mu przeciwdziałać. Takim rozwiązaniem jest m.in. wprowadzenie wspólnej europejskiej oceny klinicznej (Joint Clinical Assessment – JCA). Rozporządzenie weszło w życie z początkiem stycznia 2022 roku i zacznie obowiązywać już za osiem miesięcy dla leków terapii zaawansowanych i nowych leków onkologicznych. Od 2028 r. JCA obejmie też leki sieroce, a od 2030 r. już wszystkie nowe produkty rejestrowane przez EMA. To rozwiązanie wprowadza wiele mechanizmów i narzędzi, które mogą realnie poprawić i wyrównać szanse dostępu do leków w krajach UE (między innymi identyfikacja nowych technologii, doradztwo naukowe, wspólna metodologia). Warunkiem sukcesu jest jednak realne wdrożenie procedur we wszystkich krajach UE.
Konieczne jest szybsze tempo wyrównywania luk w dostępie do innowacyjnych terapii w Polsce i mocny impuls do rozwoju innowacji w UE
Wyniki badania W.A.I.T. kolejny rok dowodzą nierówności w dostępie do innowacyjnego leczenia w różnych krajach Europy o odmiennych systemach refundacyjnych oraz różnych wskaźnikach PKB. Różnica w dostępie do innowacyjnych leków między krajem o najlepszym wyniku a najgorszym wynosi 84 proc. w 4-letniej kohorcie i 80 proc. w przypadku dłuższych ram czasowych.
Dane wskazują również na konieczność poprawy tempa udostępniania innowacji medycznych, aby Unia Europejska mogła odpowiedzieć na aktualne wyzwania zdrowotne, w tym starzejące się społeczeństwo i alarmujące prognozy dot. wzrostu zachorowań na raka. Tymczasem średni wskaźnik dostępności innowacyjnych terapii w Unii Europejskiej spadł z 45 proc. do 43 proc., a średni czas oczekiwania na nowy lek na rynku europejskim wydłużył się o 14 dni i wynosi 531 dni.
Wyzwania zdrowotne, jakie stoją przed krajami UE stają się coraz poważniejsze a nierozwiązane problemy stają się coraz większymi barierami. Jesteśmy w trakcie pierwszej od 20 lat reformy prawa farmaceutycznego a finał prac legislacyjnych przypadnie na okres polskiej prezydencji.
– Od decyzji jakie zapadną z udziałem polskiego rządu będzie zależało to, czy UE znów będzie konkurencyjnym regionem na świecie, który daje mocny impuls do rozwoju innowacji, badań klinicznych, kształcenia najlepszych kadr i sprawiedliwego dostępu do nowoczesnego leczenia bez względu na kraj zamieszkania. Pamiętając o tym, jak ważne jest w Polsce przyspieszenie tempa wyrównywania luk do już zarejestrowanych terapii polski rząd nie powinien tracić z oczu szerszej perspektywy korzyści gospodarczych i zdrowotnych dla naszego społeczeństwa, co także jest fundamentalnym filarem bezpieczeństwa lekowego kraju i UE – podkreśla Agnieszka Grzybowska-Zalewska, Prezes Zarządu INFARMA.
Tegoroczne dane W.A.I.T. dotyczą 36 krajów (w tym 27 z Unii Europejskiej), a analizie poddano 167 innowacyjnych leków, które uzyskały centralne pozwolenie na dopuszczenie do obrotu w latach 2019-2022. Badanie przeprowadzono z rocznym opóźnieniem, aby umożliwić krajom włączenie tych leków do publicznego wykazu refundacyjnego, co oznacza, że dane dotyczące dostępności są dokładne na dzień 5 stycznia 2024.
Źródło: informacja prasowa